Las disoluciones químicas son mezclas homogéneas que tienden a componerse de un soluto y un solvente, mientras que las mezclas heterogéneas son aquellas que se diferencian de las anteriores ya que a simple vista sus componentes tienden a observarse. Sin embargo, existen otras mezclas que son conocidas por ser más peculiares, especialmente porque sus elementos son dos solventes. Estamos hablando de las disoluciones acuosas y en este artículo ampliaremos el tema con el fin de conocer estas mezclas.
Cuando mencionamos una disolución acuosa, automáticamente se entiende que se trata de una mezcla que se encuentra en un estado líquido, y efectivamente, al concentrar dos disolventes en los cuales el agua tiende a ser el de más cantidad, la mezcla finalmente será totalmente líquida. Es un tipo de mezcla que cuenta con un nivel elevado de importancia, especialmente para la naturaleza y para la industria química.

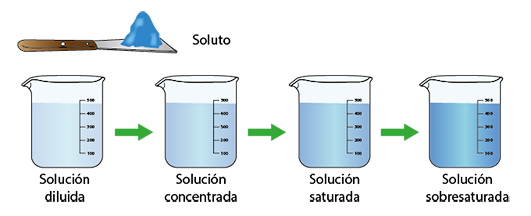
Es importante tener en cuenta que a las disoluciones hay que estudiarlas a fondo ya que una disolución química es fácilmente confundida con una solución acuosa, debido a su estado de la materia. Es necesario establecer las diferencias en cuanto a sus características, especialmente porque las disoluciones tienden a tener en sus mezclas un solvente y uno o más solutos, dividiéndose en tipos gracias a sus niveles de concentración.
Estos pueden ser disoluciones diluidas (con poco soluto), disoluciones concentradas (con un nivel suficiente de soluto), disoluciones saturadas (las cuales soportan más soluto a ciertas temperaturas) y disoluciones sobresaturadas (las cuales tienden a precipitarse al agregar demasiado soluto a la mezcla ya saturada).
Qué son las disoluciones acuosas
Las disoluciones acuosas son aquellas que se definen como soluciones que cuentan con dos solventes, en donde la presencia del agua como el solvente mayor, no falla. Además, el agua se utiliza como el descomponente inicial para cualquier sustancia, aunque exista otro solvente dentro de la mezcla.

Utilizando una connotación técnica, en química, se establece que una mezcla es acuosa cuando luego del nombre químico, se escribe: (aq). Existen distintos tipos de disoluciones que ocurren de acuerdo a las sustancias existentes; por ejemplo, las sustancias hidrófilas son aquellas se caracterizan por combinarse fácilmente con el agua ya que sus iones se disocian rápidamente con este solvente. Sin embargo, se encuentran aquellas sustancias conocidas como hidrófobas, las cuales no suelen combinarse de la forma correcta con el agua, tomándose en cuenta como temerosas a este líquido. Un ejemplo claro de estas sustancias hidrófobas, es el aceite, el cual al combinarse con el agua forma una capa que se diferencia rápidamente en la mezcla.
Características y propiedades generales de las disoluciones acuosas
Las soluciones acuosas se diferencian de las demás gracias a sus características y propiedades, especialmente porque las mismas están bien definidas y logran identificarse rápidamente. Para comenzar, se ha de destacar que una solución acuosa es aquella que conduce electricidad, ya que las mismas contienen electrolitos fuertes que funcionan en la mezcla como conductores de electricidad, en donde el ejemplo más contundente tiende a ser el agua de mar. Cuando se trata de mezclas que contienen cantidades menores de electrolitos, se les conoce como conductores menores, como sería el agua común que sale del grifo del baño. La diferencia entre estos dos líquidos, es que ambos cuentan con electrolitos pero en escalas altamente diferenciables.

Lo anterior ocurre gracias a que estos electrolitos altamente enérgicos cuentan con iones que se encuentran en el agua, los cuales ayudan a mantener la energía corriendo a través de los mismos. Esto fomenta la producción de reacciones químicas de doble desplazamiento, las cuales son mejor conocidas como metátesis.
En estas combinaciones ocurren enlaces iónicos, debido a que el catión de uno de los reactivos toma el lugar del otro catión en el otro reactivo, lo que acaba formando este tipo de procesos que también suelen ser conocidos como cambios de pareja.
Otra de las características principales de este tipo de disoluciones, es que las mismas son capaces de medirse a través de su término ácido, su base y su pH. Es decir, tomando como ejemplo el vinagre, siendo este una solución acuosa, al mismo se le puede medir el pH debido a que son ácidos débiles.
Ejemplos de disoluciones acuosas
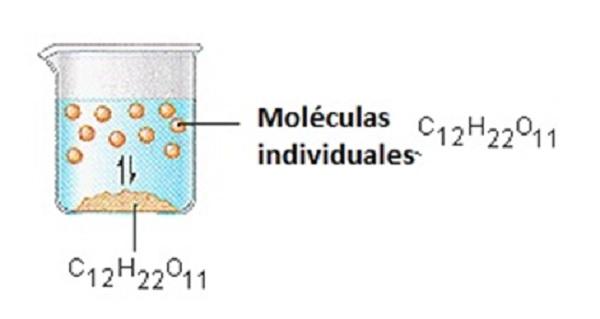
Las disoluciones acuosas se pueden encontrar en laboratorios químicos, en nuestra cocina o en cualquier otra parte del mundo, especialmente si se logran gracias a elementos comunes. Sin embargo, para ser más específicos, a continuación les dejamos una lista con algunos ejemplos de disoluciones acuosas:
- La mezcla de agua con azúcar.
- La mezcla de vino, agua y alcohol.
- La mezcla de agua con oxígeno, la cual da vida a los seres vivos acuáticos.
- La mezcla de agua con cloruro de sodio (sal).
- La mezcla de agua con miel y limón.
- La mezcla de agua con limón y azúcar (limonada casera).
- La mezcla de agua con ácido acético (formando entonces el vinagre).